A insulina é um hormônio proteico formado por 51 aminoácidos
em duas cadeias polipeptídicas, α e β, ligadas por ponte dissulfeto. É
secretada pelas células β do pâncreas, em resposta à hiperglicemia.
A insulina é produzida inicialmente como preproinsulina, uma
cadeia polipeptídica única, na qual as cadeias α e β estão ligadas pelo
peptídeo de conexão (peptídeo c). Após ser clivado por endoproteases, o
precursor do hormônio transforma-se na forma ativa da insulina.
Produção de insulina nas células β
do pâncreas a partir da sensibilização por glicose
A
glicose é o principal secretagogo da insulina. Quando em níveis elevados, o que
ocorre, por exemplo, após a alimentação, a glicose estimula as células beta do
pâncreas a secretarem insulina. A insulina, por sua vez, desempenha papéis
fundamentais nos metabolismos dos carboidratos, lipídios e proteínas, sendo seu
efeito mais conhecido o aumento da absorção de glicose nos tecidos periféricos,
o que diminue a glicemia.
Para
estimular a célula beta a secretar insulina, a glicose deve adentrar nessas
células pancreáticas e através de uma sequência de reações e modificações no
citoplasma culminar finalmente com a exocitose da insulina. Esses mecanismos
são explicitados abaixo.
Em
período pós-prandial, quando a glicose plasmática está elevada, este substrato
energético é transportado para o interior das células β pelo GLUT 2. O GLUT2 é um
transportador de Km elevado, apresentando velocidade máxima de transporte em
concentrações altas de glicose, o que é coincidente com o período após a
alimentação.
Após a
glicose ser transportada nas células β, ela é fosforilada a glicose
6-fosfato por ação de duas isoenzimas, a hexoquinase I (glicoquinase) e a
hexoquinase IV. Esse processo garante que a glicose recém-adquirida não saia da
célula. Após fosforilada, a principal rota seguida pela glicose 6-fosfato é a
glicólise e o ciclo de Krebs. Nessa oxidação da glicose, são produzidos os
substratos NADH, FADH2 e, principalmente após a cadeia transportadora de
elétrons, ATP. Com isso, há uma superprodução de ATP nas células beta, de forma
que a razão ATP/ADP no citosol aumente. O aumento da razão ATP/ADP é um
estímulo para o fechamento dos canais de K+ e abertura dos canais de
Na+, o que causa uma despolarização da membrana plasmática e o
desencadeamento do processo exocitótico. Com as modificações no citoplasma, os
grânulos de secreção de insulina são direcionados até as proximidades da
membrana e fundem-se para secretar a insulina na corrente sanguínea.
AÇÃO DA INSULINA
A
insulina plasmática acopla-se a seu receptor na membrana das células. O
receptor da insulina apresenta duas subunidades α e duas subunidades β,
unidas por ligações de dissulfeto. Nas subunidades beta, estão ligados resíduos
de tirosina. Quando a insulina encaixa no receptor, este se autofosforila,
passando a exercer atividade tirosina quinase, que por sua vez, fosforila
outras proteínas, em uma cascata de reações.
A
cascata de reações intracelulares vai mediar os efeitos da insulina. No
metabolismo dos carboidratos, a insulina promove o aumento da absorção de
glicose, principalmente nos miócitos e hepatócitos, e aumenta a taxa de
glicólise. Estimula a síntese de glicogênio (glicogênese) e inibe a sua degradação
(glicogenólise). Suprime a gliconeogênese. No metabolismo dos lipídeos, a
insulina diminui a lipólise no tecido adiposo; estimula a esterificação de
ácidos graxos e glicerol a triglicerídeos; inibe a β-oxidação no fígado. No
metabolismo das proteínas, aumenta a absorção de aminoácidos nos tecidos;
estimula a síntese de proteínas e inibe a degradação de proteínas.
O
complexo insulina-receptor são endocitados e depois degradados, de forma que o
aumento na concentração de insulina provoca uma diminuição no número de
receptores.
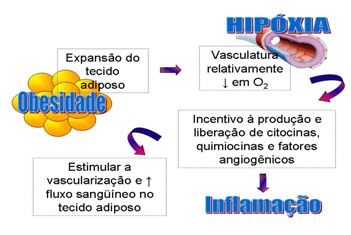
RESISTÊNCIA À INSULINA E OBESIDADE
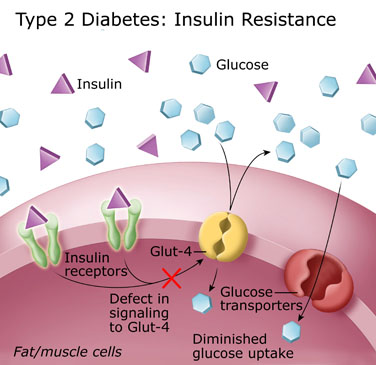
Resistência
à insulina é a inabilidade da insulina em promover seus inúmeros efeitos com a
concentração normal de insulina secretada pelas células beta. Dessa forma, em
uma resposta compensatória, a insulina passa a ser secretada em concentrações
mais elevadas (hiperinsulinemia).
A
resistência à insulina apresenta fatores genéticos e adquiridos, incluindo a
obesidade. Pode ser decorrente de uma danificação em grande número de
receptores, da diminuição do número deles, ou por problemas nas primeiras
respostas à insulina, dentro da cascata de reações.
A maior propensão de indivíduos obesos desenvolverem resistência à insulina está correlacionada com diversas abnormalidades, como a diminuição da adiponectina e níveis elevados de TNF-alfa (fator de necrose tumoral), cujas taxas nos obesos diminuem a sensibilidade à insulina e aumentam portanto a resistência à insulina. Inúmeros outros fatores estão relacionados ao desenvolvimento de resistência à insulina, como por exemplo, níveis elevados de ácidos graxos e frutose no plasma, dentre outros.
Por Débora Saraiva
Referências:
Esther P. Haber,Rui Curi, Carla R.O. Carvalho, Angelo R. Carpinelli. Secreção da
insulina: Efeito autócrino da insulina e modulação por ácidos graxos. Scielo
en.wikipedia.org